Le génome est l’ensemble du matériel génétique d’un individu codé dans son acide désoxyribonucléique (ADN).
La modification du génome est aujourd’hui possible : la technique CRISPR-Cas9 peut permettre d’éteindre ou allumer l’expression d’un gène, de le modifier, de le réparer.
1. Définition : la technique CRISPR-Cas9
Il s’agit d’une technique de génie génétique révolutionnaire qui se répand à très grande vitesse. Elle permet de modifier facilement, rapidement, à faible coût, avec un matériel simple et accessible, l’ADN de toute cellule végétale, animale ou humaine. Pour la première fois, une modification directe, facile et assez précise de l’ADN contenu dans les cellules devient possible pour un grand nombre de laboratoires.
La modification du génome de toute cellule est rendue possible en coupant de manière ciblée l’ADN pour éteindre, atténuer ou remplacer un gène. Prometteuse, elle laisse entrevoir déjà d’immenses avancées scientifiques et progrès thérapeutiques. Mais elle soulève de graves questions éthiques si elle est appliquée sur des gamètes humains ou sur l’embryon humain.
Cette technique tire son nom des deux éléments qui, combinés, agissent comme des « ciseaux moléculaires » pour découper l’ADN :
Cette enzyme spécialisée d’origine bactérienne est capable de couper l’ADN avec deux zones de coupe actives, une pour chaque brin de la double hélice de l’ADN.
- Une courte séquence répétée d’ADN (CRISPR : Clustered Regularly Interspaced Short Palindromic Repeats)
2. Comment ça marche ? Comme une sorte de « couteau suisse génétique »
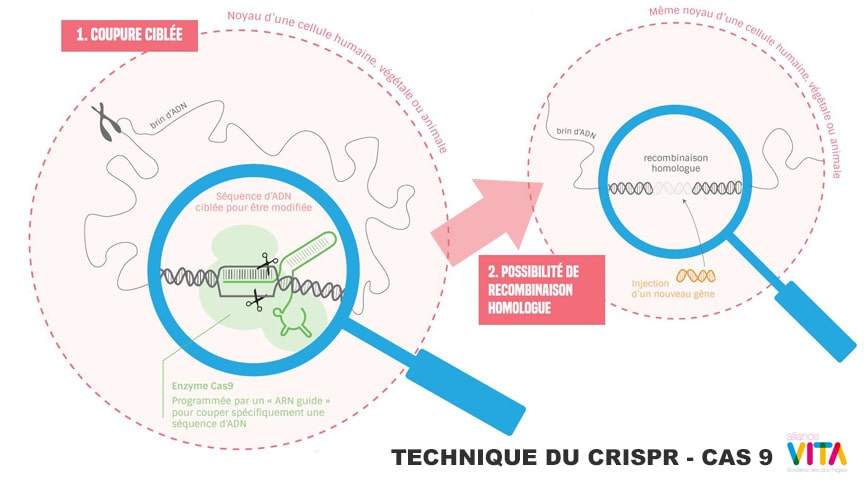
Modifier un ADN devient presque aussi simple qu’un « copier-coller » dans un traitement de texte. La combinaison CRISPR-Cas9 joue le rôle d’une tête chercheuse qui localise le segment d’ADN à modifier, avant de s’y déposer pour le découper. Une fois l’ADN coupé, il va se réparer de lui-même, éventuellement en introduisant une mutation, et il est possible d’éventuellement y intégrer un autre gène.
Pour cibler la zone d’ADN à modifier, Il suffit de fabriquer en laboratoire un « ARN guide » correspondant au gène que l’on souhaite cibler, puis de l’arrimer à une enzyme Cas9 qui coupera l’ADN.
3. Infographie CRISPR-Cas9
4. Quelles applications possibles ?
Cette technique est d’abord très utile dans le domaine de la recherche, pour mieux comprendre le rôle joué par certains gènes. Par exemple, en comparant l’activité d’une cellule dans laquelle un gène a été retiré à l’activité d’une cellule de la même lignée non-modifiée.
En thérapeutique, les espoirs soulevés par cette technique sont très nombreux pour corriger les maladies génétiques et promet d’immenses progrès de thérapie génique. Par exemple, des travaux ont été publiés récemment sur l’utilisation du CRISPR-Cas9 sur des souris, ciblant les gènes défectueux responsables de la myopathie de Duchenne avec des résultats prometteurs. Egalement, des chercheurs ont pu améliorer la vision de souris atteintes d’une maladie dégénérative héréditaire qui les rendait aveugles. Pour améliorer la compatibilité des organes porcins avec l’être humain, une autre équipe de scientifiques a pu retirer simultanément 62 gènes dans le génome du cochon, levant un certain nombre d’obstacles à la xénotransplantation (transplantion inter-espèces). Il serait également envisageable de corriger les mutations du gène BRCA1 (qui favorise le cancer du sein) ou d’autres formes de cancer, de réparer la mutation du gène CFTR codant pour la mucoviscidose, d’agir sur la β-thalassémie, et même sur le sida.
5. Quels sont les problèmes éthiques soulevés ?
La technique en elle-même ne pose pas de problème éthique. C’est bien « l’usage » qui en sera fait qui en pose. Distinguons deux catégories de cellules :
- Cellules somatiques : elles constituent l’immense majorité des cellules constituant un individu. Ce sont toutes les cellules n’appartenant pas à la lignée germinale (gamètes).
La modification du génome appliquée sur des cellules somatiques ciblées (cellules d’un adulte, consentant) ne soulève pas ou peu de problèmes éthiques. Quelques précautions sont néanmoins nécessaires, notamment liées aux problèmes de la spécificité de la méthode : les petits « ARN guides» ne sont pas obligatoirement spécifiques d’une seule séquence d’ADN, ils peuvent donc introduire des mutations en des endroits non désirés.
- Cellules germinales et embryon humain.
Les cellules germinales sont les gamètes : spermatozoïdes et ovocytes.
S’il est désormais possible de modifier n’importe quelle cellule, c’est le cas aussi pour l’embryon humain et les cellules germinales. C’est là que se situe la question éthique, voire sanitaire, majeure.
Principaux problèmes éthiques :
- « Bébé sur mesure». La technologie peut être utilisé pour dicter quels gènes un embryon devrait ou ne devrait pas avoir. Avec à la clé la possibilité de « créer » des enfants sur mesure, conduisant à de possibles dérives eugéniques.
- Modification transmissible aux générations suivantes. Les modifications génétiques subies par un embryon affecteront également ses cellules germinales, ovocytes pour les femmes, spermatozoïdes pour les hommes. Ainsi, les modifications se transmettront aux générations suivantes, de façon définitive et avec des conséquences impossibles à anticiper.
- « Effet mosaïque ». La technique appliquée sur l’embryon humain au stade de quelques cellules soulève une autre question cruciale. Il sera impossible de s’assurer que toutes les cellules de l’embryon seront réellement modifiées. Si la vérification par un Diagnostic Pré Implantatoire (DPI) est possible sur une cellule, elle ne le sera pas sur toutes, puisqu’il faut pour cela la prélever de l’embryon et en faire son séquençage. Un « effet mosaïque » peut arriver : c’est-à-dire que certaines cellules seraient modifiées, d’autres non, et ceux qui manipuleraient ainsi l’embryon avant son implantation n’en auraient pas connaissance. Les conséquences sur la santé de l’enfant à naître ne pourraient alors se vérifier « que sur lui-même » à la naissance ou même des années plus tard.
6. Historique : CRISPR-Cas9 et l’embryon humain
Depuis des années, de nombreuses équipes dans le monde travaillent sur ces sujets. Plusieurs étapes de découvertes successives ont finalement abouti à une publication par Jennifer Doudna et Emmanuelle Charpentier en 2012.
Mars 2015 : Appel de scientifiques à un moratoire sur cette technique appliquée à l’embryon humain.
Avril 2015. : Annonce d’une équipe chinoise ayant franchi la ligne rouge dans son laboratoire, en utilisant la méthode du Crispr-cas9 sur des embryons humains non-viables.
2 septembre 2015 : l’Académie des sciences médicales (AST) et plusieurs conseils et associations ont signé une déclaration commune de soutien sur la recherche et le financement des méthodes de modification du génome, notamment celles liées à l’utilisation de la technique du « CRISPR / cas9.
18 Septembre 2015 : Demande d’une équipe anglaise d’utiliser cette technique sur des embryons humains à des fins de recherche.
5 Octobre 2015 : Comité international de bioéthique de l’Unesco : appel à un moratoiresur les techniques d’édition de l’ADN des cellules reproductrices humaines afin d’éviter une modification contraire à l’éthique des caractères héréditaires des individus, qui pourrait faire resurgir l’eugénisme.
1-3 Décembre 2015 : Conférence à Washington, le « Gene Edit Summit » axé notamment sur les questions éthiques liées à l’utilisation du CRISPR-Cas9
9 décembre 2015 : Colloque à l’Université de Londres. Organisé par l’ Educational Trust Progrès (PET), au cours de laquelle le conseiller scientifique du gouvernement, le professeur Sir Mark Walport, a annoncé « qu’il croit qu’il y a des circonstances dans lesquelles la modification génétique des embryons humains pouvait être acceptable et que la Grande-Bretagne devait ouvrir cette voie ».
1er février 2016 : l’autorité britannique de la fertilisation humaine et de l’embryologie, la HFEA, a autorisé une équipe de scientifiques à manipuler génétiquement, pour la première fois au Royaume-Uni, des embryons humains à des fins de recherche. Ces embryons devront être détruits au bout de 14 jours.
7. Quelles sont les réglementations sur ce sujet ?
La technique a largement dépassé les législations internationales et nationales.
Procéder à des manipulations génétiques en amont de la fécondation ou sur des cellules reproductrices est interdit : cela fait partie des principes éthiques qui s’appliquent à l’ensemble des chercheurs. Mais chaque pays a son cadre réglementaire, et certains n’en ont pas du tout. La Chine, par exemple, est très permissive.
La conférence d’Asilomar a été organisée en 1975 par Paul Berg (futur prix Nobel de chimie en 1980). L’objectif de cette conférence n’était pas simplement d’exposer les avancées dans un domaine de recherche, le génie génétique, bien que cela occupât la partie la plus importante de ce congrès, mais aussi de débattre sur les risques et la sûreté des expériences de ce domaine naissant. Elle appelait à un moratoire sur les manipulations génétiques, afin d’éviter que des bactéries génétiquement modifiées puissent se disperser dans l’environnement. Elle a réuni à huis clos en Californie 150 chercheurs venus de toute la planète du 24 au 27 février 1975. Les chercheurs n’y ont pas trouvé de consensus et ont conclu à une levée du moratoire, mais avec mise en place de conditions de précaution et de sécurité renforcées (confinement des OGM en particulier).
- La Convention d’Oviedo : protection des droits humains dans le domaine biomédical
La France a ratifié en 2011 cette Convention qui est le seul instrument juridique contraignant international pour la protection des Droits de l’homme dans le domaine biomédical. Cette Convention sur les Droits de l’homme et la biomédecine a été ouverte à la signature le 4 avril 1997 à Oviedo (Espagne).
La Convention cadre vise à protéger la dignité et l’identité de tous les êtres humains et à garantir à toute personne, sans discrimination, le respect de son intégrité et de ses autres droits et libertés fondamentales à l’égard des applications de la biologie et de la médecine. Elle reprend les principes développés par la Convention européenne des Droits de l’Homme dans le domaine de la biologie et de la médecine. Cette convention internationale, signée par la plupart des Etats européens, énonce les principes fondamentaux applicables à la médecine quotidienne ainsi que ceux applicables aux nouvelles technologies dans le domaine de la biologie humaine et de la médecine.
L’article 13 est consacré aux interventions sur le génome humain : une intervention ayant pour objet de modifier le génome humain ne peut être entreprise que pour des raisons préventives, diagnostiques ou thérapeutiques, et seulement si elle n’a pas pour but d’introduire une modification dans le génome de la descendance.
La France s’est dotée de lois bioéthique successives, l’article 16-4 du code civil et L 2451-2 du code de la santé publique interdit toute modification du patrimoine héréditaire de l’espèce humaine.
La France ayant ratifié la convention d’Oviedo, l’article 13 s’applique et interdit à notre pays d’accepter des modifications du génome sur les cellules germinales et les embryons humains.
Un flou a-t-il déjà pénétré notre législation ? De récentes modifications du statut de la recherche sur l’embryon sont apparues dans la loi de modernisation du système de santé, dite « loi Santé », du 26 janvier 2016. A l’initiative du Gouvernement qui a fait voter un amendement à l’Assemblée nationale, cette loi instaure au paragraphe III de l’article 155 une disposition qui permet, dans le cadre de l’assistance médicale à la procréation et avec le consentement des membres du couple, la réalisation de recherches biomédicales sur des gamètes destinés à constituer un embryon ou sur un embryon in-vitro avant ou après son transfert à des fins de gestation.
Cet article avait fait l’objet d’un recours au Conseil Constitutionnel, les auteurs de la saisine jugeant qu’un changement de cette nature relevait de la loi bioéthique et non d’un projet de loi santé. Le Conseil constitutionnel l’a estimé pourtant conforme à la Constitution.
Si aujourd’hui les embryons génétiquement modifiés doivent être détruits, comme le stipule l’autorisation faite à la scientifique britannique, qu’en sera-t-il demain ? Quelles pourraient être les prochaines propositions ou revendications lorsque cette technique aura encore progressé ? Aboutiront-elles à implanter des embryons génétiquement modifiés dans des utérus, en vue de faire naître des enfants exempts d’une pathologie ou sélectionnés selon certains critères ? Comment prémunir les législations d’avancer dans ce sens ?
Conclusion
L’ADN humain et les droits de l’homme : le génome humain fait partie du « patrimoine de l’humanité».
Le Comité international de bioéthique de l’Unesco a, le 5 octobre 2015, interpellé la communauté internationale sur question de la dignité, rappelant que le génome humain fait partie du « patrimoine de l’humanité », ce qui souligne « la valeur exceptionnelle de ce qui doit être protégé et transmis aux générations futures ». Les techniques qui vont induire des modifications importantes du génome transmissibles aux générations futures risquent donc grandement de «mettre en péril la dignité inhérente et donc égale de tous les êtres humains et de faire renaître l’eugénisme, déguisé comme l’accomplissement du désir d’une vie améliorée ».
C’est pourquoi « le génome humain est un des fondements de la liberté » :
Le rapport de l’Unesco, soulignant l’importance des progrès scientifiques, rappelle que « nous sommes humains grâce à l’interaction permanente de nombreux déterminants biologiques, historique et culturels, ce qui nous permet de ressentir un sentiment fondamental d’unité et qui nourrit la richesse de notre diversité. C’est pourquoi le génome humain est un des fondements de la liberté, et non une matière première malléable à loisir ».
Un appel au Comité Consultatif National d’Ethique
La technique du CRISPR-Cas9 est prometteuse ; elle laisse entrevoir des progrès de thérapie génique fulgurants.
Mais dès lors que l’on touche à l’embryon humain, ou aux gamètes humains, les questions éthiques soulevées sont cruciales. Plus qu’un principe de précaution, c’est l’impératif de protection de tout être humain qui devrait s’appliquer. Nous risquons l’avènement du bébé à la carte et la modification transmissible du génome humain : ce patrimoine mondial de l’humanité que nous devrions collectivement protéger est en danger.
Alliance VITA a donc pris l’initiative de demander officiellement au Comité Consultatif National d’Ethique de s’auto-saisir de la question. La France doit assumer son statut de référence éthique contre toute marchandisation du corps et pour le respect de la dignité humaine.
VOIR AUSSI :
Sondage IFOP : « Les Français et la technique du CRISPR-Cas9 »
76% des Français seraient ainsi favorables à l’utilisation du CRISPR-Cas9 sur des adultes ou des enfants souffrant d’une maladie d’origine génétique dans le cadre d’une thérapie génique pour soigner ou améliorer leur qualité de vie.
Mais à l’inverse, exactement la même proportion (76%) seraient opposés (dont 40% très opposés) au recours à cette technique pour modifier génétiquement in vitro des embryons humains.


![[CP] CRISPR-Cas9 et être humain génétiquement modifié : une question dont la France doit vite se saisir](https://www.alliancevita.org/wp-content/uploads/2015/04/genome.png)